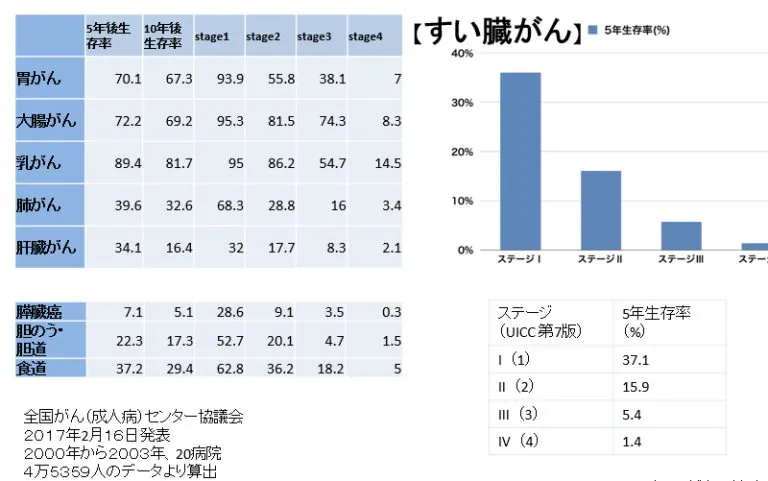
膵臓がん
主な膵臓がん治療法
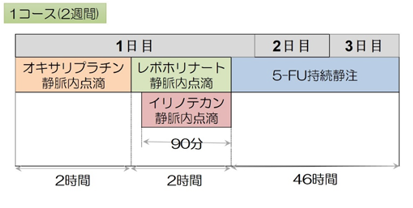
フォルフィリノックス(FOLFIRINOX)療法:5-FU・イリノテカン・オキサリプラチンの3種類の抗がん剤に、5-FUの増強剤であるレボホリナートを加えた多剤併用の治療法です。2週間ごとに繰り返す治療ですが、1回あたり2日間かかるため、外来・在宅で治療を行うために、皮下に埋め込み型のポートを造設する小手術を行う必要があります。最も推奨度の高い治療のひとつですが、副作用(感染症・下痢・しびれ、など)の頻度も高く、十分な体力があり、全身状態が良好な方が対象になります。当院では、副作用を低減するために、当院主導で行った多施設共同試験の結果を踏まえ、予め修正を加えた投与法(modified FOLFIRINOX)で治療を行っています。
・有明癌研一次治療成績*:80例(2014-2017年):
生存期間:17.1ヶ月
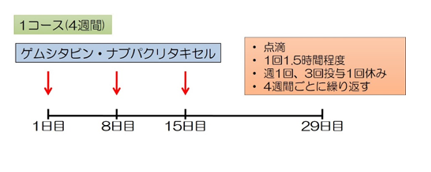
ゲムシタビン・ナブパクリタキセル療法(Gem/nab-PTX療法, GnP療法) 1回60-90分の点滴を、週1回で3週連続行い4週目を休む、4週間1コースのスケジュールで繰り返す治療法です。FOLFIRINOX療法と並んで、最も推奨度の高い治療法のひとつですが、副作用(感染症・しびれ、脱毛など)の頻度も高く、やはり、ある程度の体力があり、全身状態が良好な方が対象になります。
・有明癌研の一次治療成績*(2015-2017年):
生存期間中央値:14.1ヶ月
すい臓がん二次治療について

リポソーマルイリノテカン・5FU/LV療法(Nal-IRI/FL療法):2020年6月に保険承認された治療法で、先述のFFX療法からオキサリプラチンを外し、イリノテカンをリポソーム型イリノテカンに組み替えた、二次治療用*の併用療法です。FFXと同様に2週間ごとに繰り返す治療で、1回あたり2日間かかるため、皮下に埋め込み型のポートを造設する小手術を行う必要があります。イリノテカンをリポソームのナノ粒子に封入したのがリポソーム型イリノテカンで、抗がん剤をナノ粒子に封入することにより、抗がん剤をがん細胞が存在する組織により選択的に届けられるようにすることで、イリノテカンの副作用を軽減すると考えられています。
二次治療について
FFX療法とGnP療法は一次治療として確立した治療法ですが、二次治療に関しては、安全性と有効性が科学的に証明されないまま、十分な体力がありそうな患者さんに対して、みなし標準的に使われてきました。Nal-IRI/FL療法はゲムシタビンベースの一次治療後の二次治療として、FL療法と比して有効性が証明された治療法ですが、FFX療法と比較しているわけではないため、FFX療法との優劣はまだよく分かっていません。FFX療法と比べ、体力的な面で対象患者さんのすそ野が広がるものと期待されますが、FFX療法が十分できそうな患者さんに対してどちらを用いるかに関しては、今後の臨床データの蓄積が必要です。
切除不能膵癌に対する FOLFIRINOX 治療の実際
- 我が国における膵癌による死亡者数は平成 25 年に 30672 人と,ついに 3 万人を突破し肝臓癌を 抜いて癌死亡の第 4 位の順位となり,なお増加中 である.膵癌は診断時に進行しており非切除例の 割合が多いため治療には化学療法が重要であると考えられています。
- 切除不能膵癌に対する化学療法は長らくゲムシタビン(GEM)が標準治療であっ た.これに続いて GEM+Erlotinib 併用療法,S―1 が用いられるようになったが,3 つのレ ジメンには治療成績において大きな差はなかった.FOLFIRINOX 治療はフランスで行わ れた GEM との比較試験で生存期間に大きな差を持って優越性を示し,欧米では迅速に標準治療の一つに加えられた.日本でもほぼ同様のレジメンで治験が行われ,良好な成績を 得たため 2013 年 12 月承認。
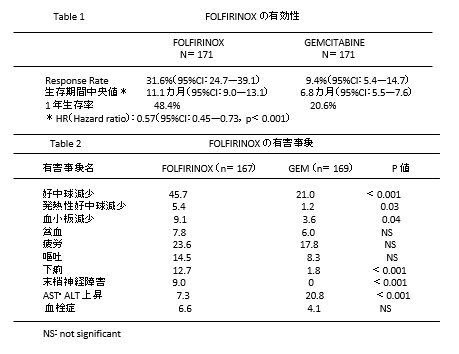
2011 年に Conroy4)らが報告した遠隔転移を有 する膵癌に対する FOLFIRINOX 療法は GEM と の比較試験として行われ,明らかな優越性を示した。FOLFIRINOX 試験(ACCORD 11)試験デザイン 遠隔転移のある膵癌を対象とし,PS,膵癌の原発部位で 層別化したのち,GEM 群と FOLFIRINOX 群に無作為に 割り付けた
遠隔転移を有する膵癌 で,適格条件は 18 歳以上,ECOG(Eastern Cooperative Oncology Group)の Performance Status (PS)5)が 0 または 1,黄疸がない,骨髄機能が保た れている(好中球数が 1500mm3 以上,血小板数が 100000mm3 以上),肝臓や腎臓などの重要臓器機 能が保たれていることなどであった.除外項目と しては 76 才以上,内分泌腫瘍や腺房細胞癌,膵癌 に対する放射線治療歴のあるもの
ASCOエキスパートのAndrew Epstein医師発表
の第3相ランダム化比較試験
(米国臨床腫瘍学会(ASCO) ASCO2018年
- 第3相ランダム化比較試験において、手術で膵臓がんを切除した患者が4種類の薬剤を含むレジメンであるmFOLFIRINOX(オキサリプラチン、ロイコボリン、イリノテカン、5-フルオロウラシル)による化学療法を受けたところ、現在の標準治療であるゲムシタビン(商品名:ジェムザール)を受けた患者と比較して、中央値で生存期間が20カ月延長し、がんが再発しない期間は9カ月延長した
- (研究内容)PRODIGE24/CCTG PA.6臨床試験は、転移がなく、腫瘍をすべて、または、ほぼすべて切除した(手術後に外科医がみてもがん細胞は視認できないが、微小な腫瘍細胞が残っているかもしれない状態)膵臓腺がん(PDAC)患者を対象とした。膵臓腺がんは膵臓がんの中で最も多い種類で、全症例の90%を占める。手術が可能なのは膵臓がん患者全体のわずか10~20%である。米国では、2018年に55,400人が膵臓がんと診断されると推定されている。
- (主な知見)中間値で33.6カ月の追跡時点で、膵臓がんが再発していない期間の中間値(無病生存期間)はゲムシタビン群(12.8カ月)よりもmFOLFIRINOX群(21.6カ月)の方が断然長く、全生存期間の中央値もmFOLFIRINOX群の方が断然長かった(mFOLFIRINOX群で54.4カ月に対し、ゲムシタビン群では35.0カ月)。mFOLFIRINOXの利益は患者集団の全てにおいて確認された。また、mFOLFIRINOXは、転移が出現するまでの期間も著しく延長した(中央値で30.4カ月。ゲムシタビンの場合は17.0カ月)。
| 疾患 | 膵臓がん | ||
|---|---|---|---|
| 臨床試験のフェーズと種類 | 第3相、ランダム化比較試験 | ||
| 患者数 | 493人 | ||
| 研究対象 | mFOLFIRINOXによる補助化学療法 とゲムシタビンによる補助化学療法(標準治療)との比較 | ||
| 主な知見 | 無病生存期間の中央値がmFOLFIRINOXで21.6カ月だったのに対し、ゲムシタビンでは 12.8カ月だった | ||
| 副次的な知見 | 全生存期間の中央値がmFOLFIRINOXでは54.4カ月だったのに対し、ゲムシタビンでは35 カ月だった | ||
今後検討される治療
マイクロサテライト不安定性検査(MSI検査)によるペムブロリズマブ(キイトルーダ)の適応について
がん遺伝子検査の1つである「マイクロサテライト不安定性」検査について、保険診療の中で「すべての固形がん」を対象に実施することを認める。(2500点)R3年8月25日
ヒトの細胞は常に分裂を繰り返しています。分裂は、▼細胞内のDNAの2本鎖がほどける→ ▼1本になった鎖の「対」となる形で新しい鎖がつくられる → ▼元の1本鎖と新しい1本鎖とが結びつき、2つの2本鎖となる―という工程で進みます。この新しい鎖を作る際にエラー(ミス)が生じることがあります。多くの場合、エラー(ミス)は修復されますが、修復機能が衰えていることがあり、その場合「がんになりやすい」状態と言えます。このエラー修復機能が衰えている状態を「マイクロサテライト不安定性」と呼びます。
マイクロサテライト不安定性=がんになりやすい状態、抗がん剤選択で重要ポイント
⇒保険収載されました
局所進行、もしくは転移が認められた標準的な治療が困難な固形がんの抗がん剤治療法選択を目的とする場合→2500点(イ「処理が容易なもの」のうち(1)「医薬品の適応判定の補助等に用いるもの」として)
(ⅰ)肺がんにおけるEGFR遺伝子、ROS1融合遺伝子検査、ALK融合遺伝子検査
(ⅱ)大腸がんにおけるRAS遺伝子検査、BRAF遺伝子検査
(ⅲ)乳がんにおけるHER2遺伝子検査
(ⅳ)居所進行または転移が認められた上旬的な治療が困難な固形がん、または手術後の大腸がんにおけるマイクロサテライト不安定性検査
⇩
(iv) 固形がんにおけるマイクロサテライト不安定性検査
(ⅰ)から(ⅲ)は従前どおりで、また使用目的・効果に関して「医薬品の適応を判定するための補助等に用いるもの」と薬事承認・認証を得ている体外診断用医薬品・医療機器を用いて、これらの検査を▼リアルタイムPCR法▼PCR-rSSO法▼マルチプレックスPCRフラグメント解析法▼次世代シーケンシング―によって行った場合に、本検査点数(2500点)の算定が可能である点、これら以外の方法で、▼肺がんにおけるEGFR遺伝子検査▼大腸がんにおけるRAS遺伝子検査―を行った場合には、2022年3月31日までは、D004-2【悪性腫瘍組織検査】の「1 悪性腫瘍遺伝子検査」の「イ 処理が容易なもの」のうち「(2)その他のもの」(2100点)が算定可能である点にも変更はありません。
「●●遺伝子に変異がある場合、●●抗がん剤が奏功する」という知見が明らかになってきており(がんゲノム医療)、保険診療の中でも「悪性腫瘍遺伝子検査」として実施が認められてきています(徐々に拡大されてきている)。例えば画期的な抗がん剤(免疫チェックポイント阻害剤)のオプジーボ(ニボルマブ(遺伝子組み換え))は高頻度のマイクロサテライト不安定性をもつ結腸がん・直腸がんに、キイトルーダ(ペムブロリズマブ(遺伝子組換え))は高頻度のマイクロサテライト不安定性を持つ固形がんなどへの効能効果が認められており、抗がん剤選択においてマイクロサテライト不安定性などの遺伝子検査が極めて大きな意味を持つ
すい臓がんケースレポート①
抗がん剤を3クール使用したが縮小できず、 ゲノム治療+IMRT放射線を45Gy照射 CTガイド下にて局所注入
67歳 男性
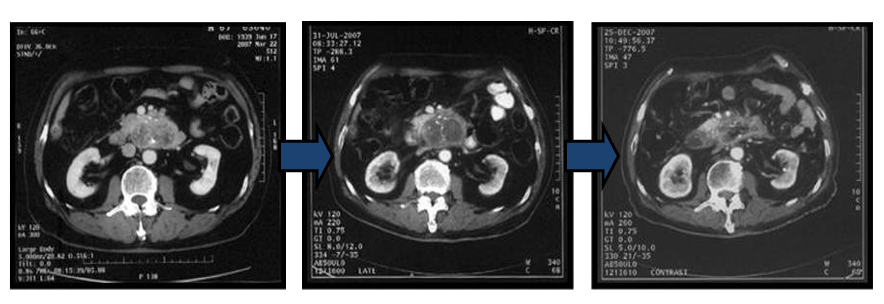
すい臓がんケースレポート②
- 2019年1月17日T大学病院にてすい臓がんステージⅡ外科手術
- P2019年3月腹膜に転移が見つかる
- 2019年7月肝臓3センチほどの転移発見
2020年7月27日(CTC検査及びゲノム検査)を実施
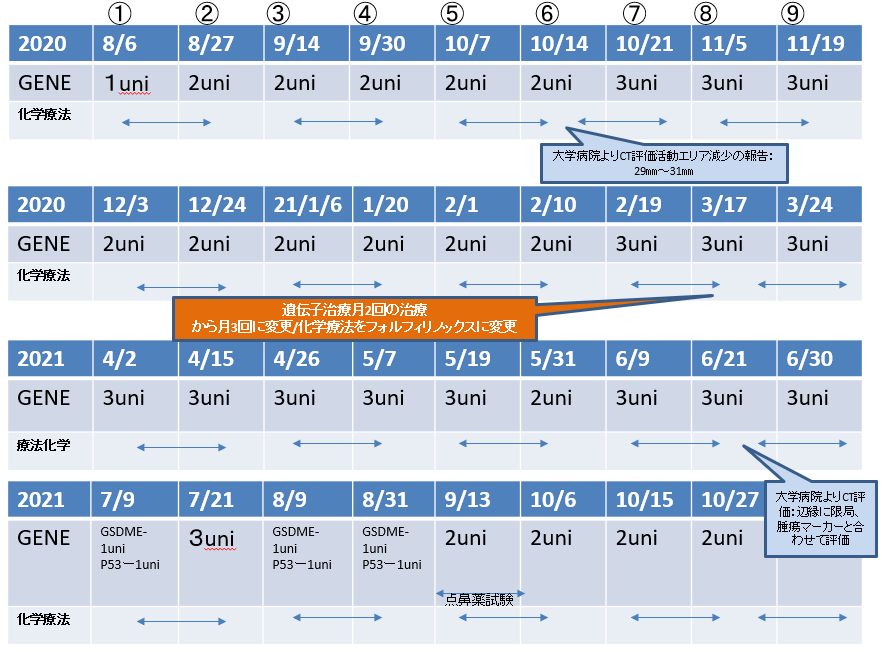
2020年8月6日第1回目遺伝子治療を開始
平行して大学病院では化学療法:ジェムザール、TS-1化学療法を実施していた
2021年4月より化学療法はフォロフィリノックスに変更
- 2022年5月以降化学療法のみで治療
- 2022年12月再び肝臓転移部分腫瘍増大
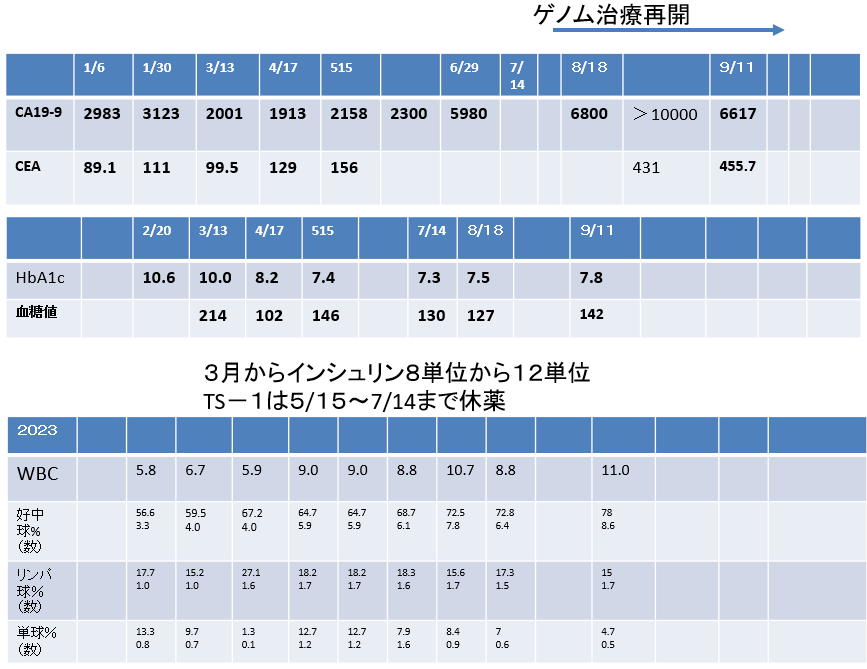
- 2023年1月よりゲノム治療再開
GENE:遺伝子治療/大学病院で化学療法
0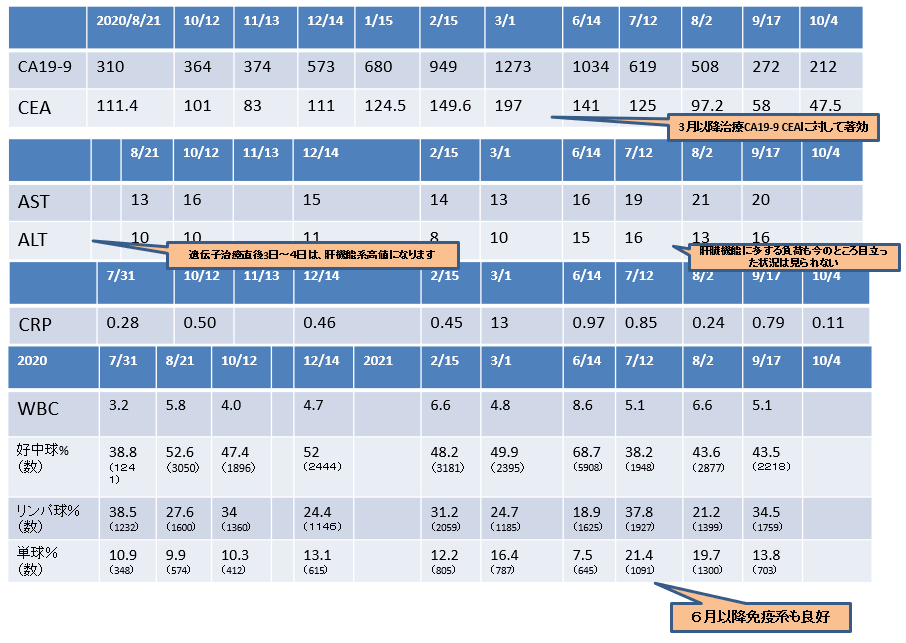
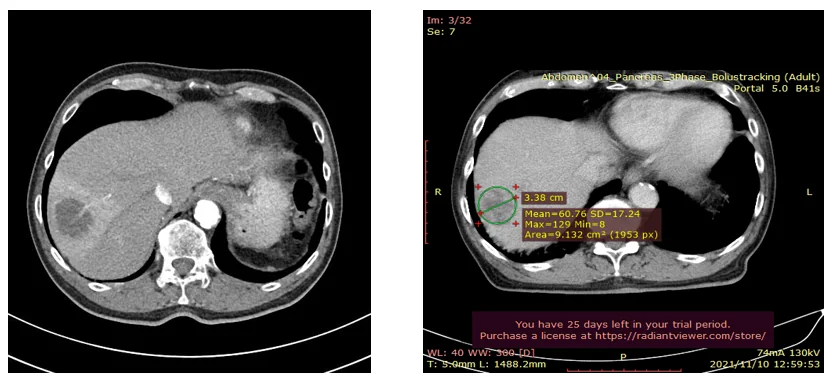
2020年12月28日 CT画像検査
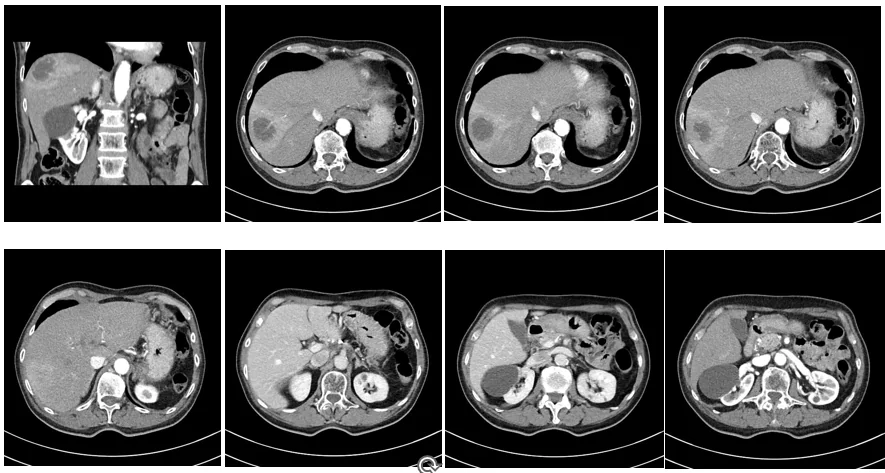
肝S8/7転移:増大しているが、造影される領域辺縁に限局している。
2020年12月28日→2021年11月10日
ケースレポート②膵臓癌術後肝転移
- 2019年発症の膵臓癌から2023年10月20日現在も治療継続中
- 完全寛解に至らずともQOL(生活の質)は良好でまもなく5年生存
- 2019年診断以降、2022年まで化学療法とゲノム点滴治療を実施、2022年5月以降一時ゲノム治療を中断するするが増悪が確認された。
- 2023年8月~は、ゲノム点滴療法と経口薬のTS1のみで治療継続中
ケースレポート②膵臓癌術後肝転移
膵頭部癌、多発肺転移・肝転移・胆管浸潤
Stage:cT4NXM1(PUL.HEP.LYM)stageⅣ,UR-M
患者:(55歳) 性別:男
4月時点:切除不能膵癌の診断で4月~GEM+nabPTXによる化学療法
:1週間に1度の化学療法を計画
好中球減少、白血球減少等で5回Skipとその都度dose減少でコントロール
GEM :1720㎎⇒1370㎎⇒1440㎎(66㎏計算)⇒1420㎎(63㎏計算)⇒ nabPTX :215㎎⇒170㎎⇒135㎎⇒132㎎ 9月より1週間おきの化学療法を実施。

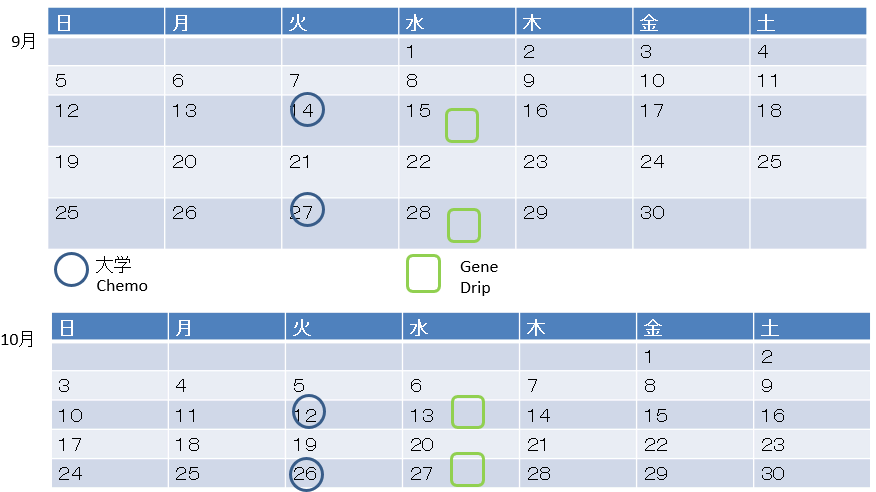
Gnp:化学療法/GENE:ゲノム点滴治療
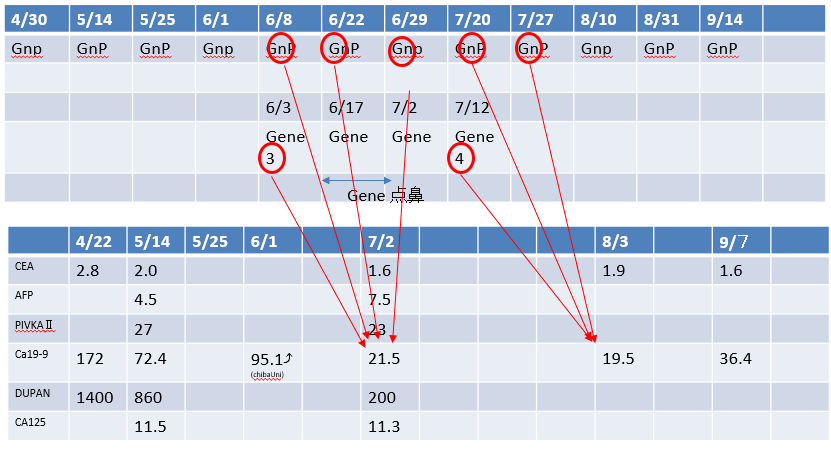
8月31日の大学病院でのCT画像の所見
- 膵頭部の乏血性腫瘤の形状=2.7㎝
- 肝S4、S6、S8に認めた肝転移は縮小して指摘困難
- #8,#13、#16、左鎖骨上リンパ節は6月前回同様
- 両肺の多発転移も6月のCT同様縮小維持
膵癌、リンパ背鉄転移、肝転移・肺転移・縮小維持
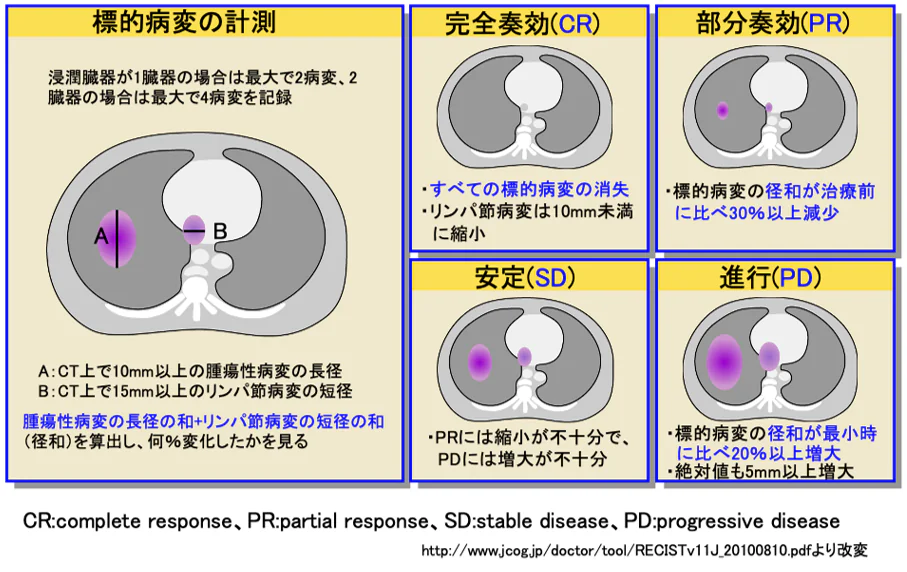
治療の評価について
膵癌はK-ras遺伝子の変異にp16 やp53 などの癌抑制遺伝子の欠失や変異が加わり,前癌病変のPanINを経て多段階的に発生する.膵癌の浸潤・転移機構には癌と間質の相互作用や上皮―間葉形質転換(EMT)といっ た現象が重要な役割を演じている.また,他の癌で示されているように,膵癌においてもEMTが誘導され ている細胞が癌幹細胞の性質を獲得し,悪性形質をさらに増している可能性がある
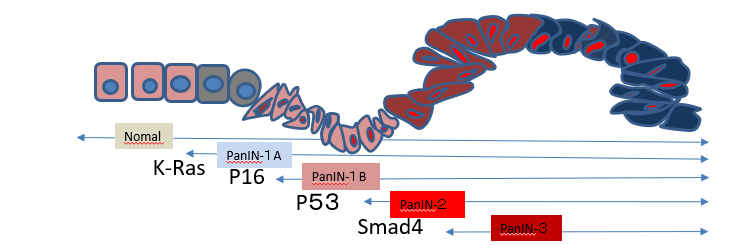
図1)PanIN分類と膵臓癌のドライバー遺伝子BIG4【KRAS、CDKN2A(p16)、TP53,SMAD4】の変化
膵癌化の最も早期にそして最も高率に異常が 認められる癌遺伝子はK-ras遺伝子である3(図 1) ) .
その変異はPanIN-1A病変の 30% 以上に認めら れ,異型度が増すに従って頻度が高くなり,膵癌病変では 90% 以上に検出される.ほとんどが exon1 のcodon12 の変異であり,glycineをコード するGGTからaspartic acidをコードするGATや valineをコードするGTTに変化することが多い. この変異によってK-ras遺伝子は活性型となり, 細胞増殖に関与する代表的なシグナル伝達経路 のひとつRas-Raf-MEK-ERKシグナル経路を活性 化し,細胞増殖を促進する K-rasの変異に続いてp16,p53,Smad4 などの 癌抑制遺伝子の異常が生ずる1(図 1) ) .
p16の異常はcyclin依存性キナーゼ(CDKs)に属し CDK4 とCDK6 によるretinoblastoma(Rb)タン パクのリン酸化を抑制している.p16 の機能が失 われるとRbタンパクのリン酸化が起こり,細胞 周期がG1 からdeoxyribonucleic acid(DNA)が 合成されるS期に移行する.その結果,細胞分裂 が誘導されると考えられている.細胞老化(senescence)とともに顕著な発現上昇が認められ ることから,細胞老化のマーカーとしても用い られている2
この遺伝子異常は様々な形で生じ,膵癌においては相同染色体の片方の変異や欠失 (loss of heterozygosity:LOH)あるいは双方の 欠失(homozygous deletion)がそれぞれ 40%, またp16 プロモーターのメチル化による機能消失 が 15% に認められ,総じて 95% とK-rasと並び 最も異常が認められる遺伝子である
p53 の異常も50~70% に認められ,相同染色 体の片方の変異や欠失によるものが多い1).p53 はDNAに損傷が生ずるとG1,G2 期で細胞周期を 停止させる.また,修復不能な遺伝子の損傷を 検出し,細胞死やアポトーシスへと誘導する1). p53 の異常はPanIN-3 病変からみられるようにな り,K-rasやp16 の異常に比べ癌化の後期に起こっ ていると考えられる.
Smad4はDPC4(deleted in pancreatic cancer locus 4)として膵癌において高率に欠失が認め られる 18 番染色体長腕の領域から単離,同定さ れた癌抑制遺伝子である3).TGFβ(tumor growth factor β)シグナルは発癌過程に対しては抑制的 に働き,後述するように癌の浸潤には促進的に 作用するといった 2 面性を持つことが知られて いるが,Smad4 はそのシグナル伝達経路の調節 因子である.
Smad4 に異常が生ずるとTGFβの細 胞増殖抑制作用が消失し,細胞増殖が促進され ると考えられている3)Smad4 の異常は膵癌において約 55% に認められ,LOHが 25%,homozygous deletionが約 30% である.また,Smad4 の不活化はPanIN-1,-2 では観察されずPanIN3 病変から観察され,膵癌化過程の後期に起こる ものと考えられる。上記の 4 つが膵癌化に関与するものとして多 くの研究者によって確証が得られている重要な遺伝子群である.その他にも,胎生期の膵形成 に重要な役割を果たしているNotchやHedgehog をはじめとした様々な遺伝子の過剰発現や変異, 欠失も膵癌の発生過程で生じていることが示さ れており1),上記遺伝子に協調して膵癌の癌化に促進的に働いているものと考えられる.膵癌化のinitiation としてK-ras遺伝子の変異が必要であり,それに, p16 あるいはp53 の変異が加わることによって癌化が促進することがわかっている1)
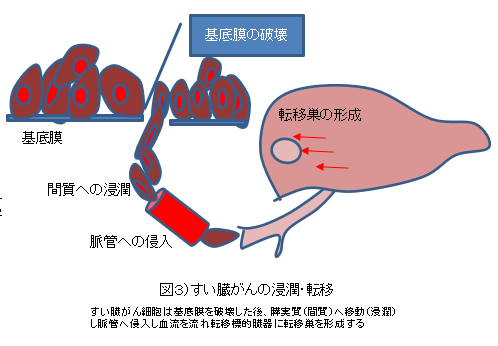
1)膵癌の浸潤・転移機構 膵癌は進行例で発見される例が多く,stage IV で発見される例が全体の 70% を超え,stage I で発見される例は 2% に満たない3).これは,膵癌の非常に高い浸潤・転移能によるものと考え られる.膵癌の転移は,図 3 に示すように,基 底膜の破壊を最初のステップとして始まる4).基 底膜は間質と比較して強固な構造物であり,上 皮細胞や内皮細胞の裏打ち構造として生体の至る所に存在し,癌細胞もそれによって囲まれている.基底膜を壊した膵癌細胞は膵実質に移動 (浸潤)し,血管やリンパ管に侵入し血流やリンパ流にのり,他の臓器に着床しそこで生育する ことで転移巣が形成される.
(1)癌―間質相互作用(cancer-stromal interaction) 膵癌は,豊富で密な線維性間質(desmoplasia) を特徴としている(図 4A,B).最近の研究から, 慢性膵炎の線維化に中心的な役割を演じている 膵星細胞(pancreatic stellate cell:PSC)が,癌においてもその間質形成に寄与していることが 明らかとなっている.癌細胞より分泌される TGFβやPDGF(platelet-derived growth factor), fibroblast growth factorなどのサイトカインや増殖因子のparacrine的な刺激によって活性化され たPSCが,コラーゲンを活発に産生しdesmoplasiaを形成する5).そして,PSCはperiostin6)やマ トリックスメタロプロティナーゼ(MMP)16)などの産生も亢進させ,癌細胞の浸潤を促進する
(2)上皮―間葉形質転換(epithelial to mesenchymal transition:EMT)EMTとは,胎生期の原腸陥入や体節形成の発生過程で上皮細胞が間葉系細胞に形態変換し細胞移動能を獲得する現象である上皮細胞にEMTが誘導されると,その細胞間接着が弱まり, 上皮系マーカーであるE-cadherinの発現低下と間葉系マーカーであるvimentinやfibronectinの 発現上昇,β-cateninの局在変化などが認められ,細胞の移動能が亢進する8).膵癌では,TGFβ シグナルがEMTを誘導することが明らかにされ, 続いてTGFβスーパーファミリーに属するbone morphogenetic protein(BMP)シグナルさらに様々なサイトカインや分子がEMTを誘導することが示され,膵癌細胞の浸潤や転移にEMTが重要な役割を演じていることが示唆されるようになった(図 5)9)
これらのEMTを誘導する物質は間質細胞でも産生されるものが多く,上 述した間質との相互作用が膵癌のEMTを促進していることも想定されている.また,EMTは癌の浸潤・転移だけではなく,化学療法耐性能の 獲得にも関与していることが明らかとなってきた
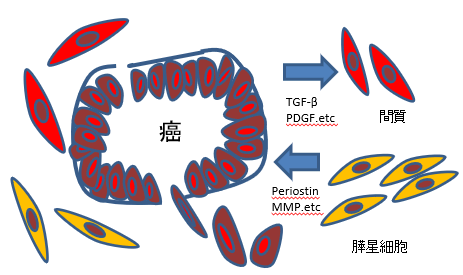
図4)がん細胞は間質細胞ではお互いにシグナルを出し合ってがんの進展を促進している
例えば、化学療法で使用されるジェムシタビンに対して薬剤耐性株 は間葉系の形態に変化し,E-cadherin発現の低下 とvimentinの発現増加を示す10).MSX2 という膵癌細胞のEMT誘導分子を膵癌細胞に過剰発 現させると,膵癌細胞はジェムシタビンと 5-FU に対して耐性を示すようになった11,12).これらの ことは,その誘導因子が何であるかに関わらず, 膵癌細胞にEMTが惹起されると化学療法耐性と なる可能性を示唆するものである.
(3)膵癌幹細胞と悪性化
抗癌薬耐性や癌再発さらに 癌の転移などの癌悪性化に関与する現象は,癌幹細胞(cancer stem cell)といわれる癌細胞の中でもごくわずかに存在する細胞群がもたらし ていることが示唆されている.癌幹細胞の特徴 として 13)自己複製能と多分化能を持つ,14)細 胞周期進行(細胞分裂速度)が遅く,通常,細胞周期の静止期にいる,1)腫瘍形成能が高い,などが挙げられている.図 5Aに示すように,癌幹細胞が分裂する際には自己と同じ性質を持つ 細胞と多様な癌細胞に分化する前駆細胞とに不 均等に分裂する.前駆細胞は様々な性質の癌細 胞に分化し,癌組織は癌幹細胞を中心としたヒ エラルキーを形成していると想定されている従来使用されている多くの抗癌薬や放 射線が細胞分裂期やDNA(deoxyribonucleic acid)合成期に作用することから,細胞周期静止期にいる癌幹細胞には効果がないことが示唆さ れている.従って,腫瘍組織が抗癌薬投与や放 射線治療を受けると,その大部分を構成する(癌 幹細胞以外の)癌細胞が減少し腫瘍組織は消滅したかにみえる.しかし,わずかに生き残った 癌幹細胞が不均等分裂を進めることによって治 療前と同様のヒエラルキーを維持した腫瘍が形 成される.癌幹細胞を中心とした癌再発はこの ようにして起こると考えられている(図 5B).
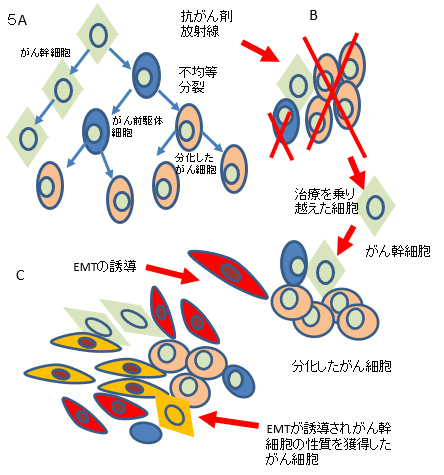
図5. 膵癌悪性化と癌幹細胞 A,癌幹細胞は不均等分裂によって自分自身と同 じ細胞と前駆細胞に分裂する.前駆細胞はさらに分化し多くの分化した癌細胞となる. B,前駆細胞や分化した癌細胞は抗癌薬や放射線 などの治療によって細胞死が誘導されるが,癌幹細胞だけは生き残る.生き残った癌幹細胞が不均等分裂によって多くの癌細胞を産生することで治 療前と同様の状態に復する. C,膵癌にEMTが誘導されると,癌幹細胞の性質を持つ癌細胞の数が増加する.この細胞はEMTによる浸潤・転移能に加え,癌幹細胞の性質である治療抵抗性を併せ持つ.
膵癌は,K-ras遺伝子の変異が引き金となり,それにp16 やp53 などの癌抑制遺伝子の変異,あるいは炎症 による刺激などが加わって発生する.その後, 癌細胞と間質細胞の相互作用やEMTの誘導によって癌細胞は基底膜を破壊する能力を獲得し浸潤癌(いわゆる膵癌)となる.膵癌細胞はEMTが誘導されている間,つまりEMT誘導シグナル が存在する間,浸潤・転移傾向を示すとともに, 癌幹細胞の性質を加えることによって様々な治 療や生体の持つ防御機構から逃れ,さらに転移巣を増やしていく.膵癌はこのような機序によって非常に高い悪性度を示すのではないかと思われる
あきらめない膵臓がん治療がここにある!
1)佐藤賢一,下瀬川徹:膵癌における遺伝子異常.最新医 学 61 : 1805―1812, 2006
2)Hara E, et al : Mol Cell Biol 16 : 859―867, 1996
3)江川新一,他:膵癌報告 2007 ダイジェスト.膵臓 23 : 105―123, 2008.
4)Satoh K, et al : Infrequent stromal expression of gelatinase A and intact basement membrane in intraductal neoplasms of the pancreas. Gastroenterology 107 : 1488― 1495, 1994.
5)Bachem MG, et al : Pancreatic carcinoma cells induce fibrosis by stimulating proliferation and matrix synthesis of stellate cells. Gastroenterology 128 : 907―921, 2005.
6)Kanno A, et al : Periostin, secreted from stromal cells, has biphasic effect on cell migration and correlates with the epithelial to mesenchymal transition of human pancreatic cancer cells. Int J Cancer 122 : 2707―2718, 2008.
7)Schneiderhan W, et al : Pancreatic stellate cells are an important source of MMP-2 in human pancreatic cancer and accelerate tumor progression in a murine xenograft model and CAM assay. J Cell Sci 120 : 512―519, 2007.
8)佐藤賢一,他:膵癌とEMT BMPシグナルとMSX2 によ る膵癌細胞のEMT誘導機構を中心に.膵臓 25 : 13―22, 2010
9)Hingorani SR, et al : Preinvasive and invasive ductal pancreatic cancer and its early detection in the mouse. Cancer cell 4 : 437―450, 2003.
10)Wang Z, et al : Acquisition of epithelial-mesenchymal transition phenotype of gemcitabine-resistant pancreatic cancer is linked with activation of the notch signaling pathway. Cancer Res 69 : 2400―2407, 2009
11)Satoh K, et al : Up-regulation of MSX2 enhances the malignant phenotype and is Associated with twist 1 expression in human pancreatic cancer cells. Am J Pathol 172 : 926―939, 2008.
12)Hamada S, et al : The homeobox gene MSX2 determines chemosensitivity of pancreatic cancer cells via the regulation of transporter gene ABCG2. J Cell Physiol, in press.
13)Sommers SC, et al : Pancreatic duct hyperplasia and cancer. Gastroenterology 27 : 629―640, 1954.
14)Hruban RH, et al : Progression model for pancreatic cancer. Clin Cancer Res 6 : 2969―2972, 2000.